Kapitel 10. Abbau und Synthese: Lipide
Die Stoffwechsellagen
Im Buch kommt die Gesamtsicht des Stoffwechsels etwas zu kurz. Der Kommentar zu den Stoffwechsellagen könnte genauso gut den Kapiteln über den Kohlehydrat-Stoffwechsel (9) oder die Ernährung (16) zugeordnet werden.
Insulin bestimmt den Stoffwechsel während und gleich nach dem Essen, der postprandialen Phase.
Die postprandiale Phase
Bedingt durch die Nahrungsaufnahme steigen die Glucose-, Aminosäure- und Lipidkonzentrationen im Blut an. Da aber langfristig erhöhte Konzentrationen schädlich sind, müssen sie so schnell wie möglich auf Normalwerte reduziert werden, ein Vorgang, für den in erster Linie Insulin verantwortlich ist (Glucose und Aminosäuren stimulieren die Insulinsekretion). Konkret (s. Figur): Insulin stimuliert die Aufnahme von Glucose in Muskel und Fettgewebe sowie die Glycogensynthese (und die Fettsäuresynthese aus Glucose). Auch die Aufnahme von Aminosäuren wird durch Insulin gefördert, gefolgt von erhöhter Proteinsynthese (Insulin ist ein anaboles Hormon!). Fettsäuren werden nach der Aufnahme im Darm zum grössten Teil als Triglyceride in Lipoproteinen transportiert (s. Abbildung 7.5) und, nach Aufnahme v.a. im Fettgewebe, als Triglyceride gespeichert. Das Hirn deckt seinen Energiebedarf in dieser Phase vor allem mit Glucose.
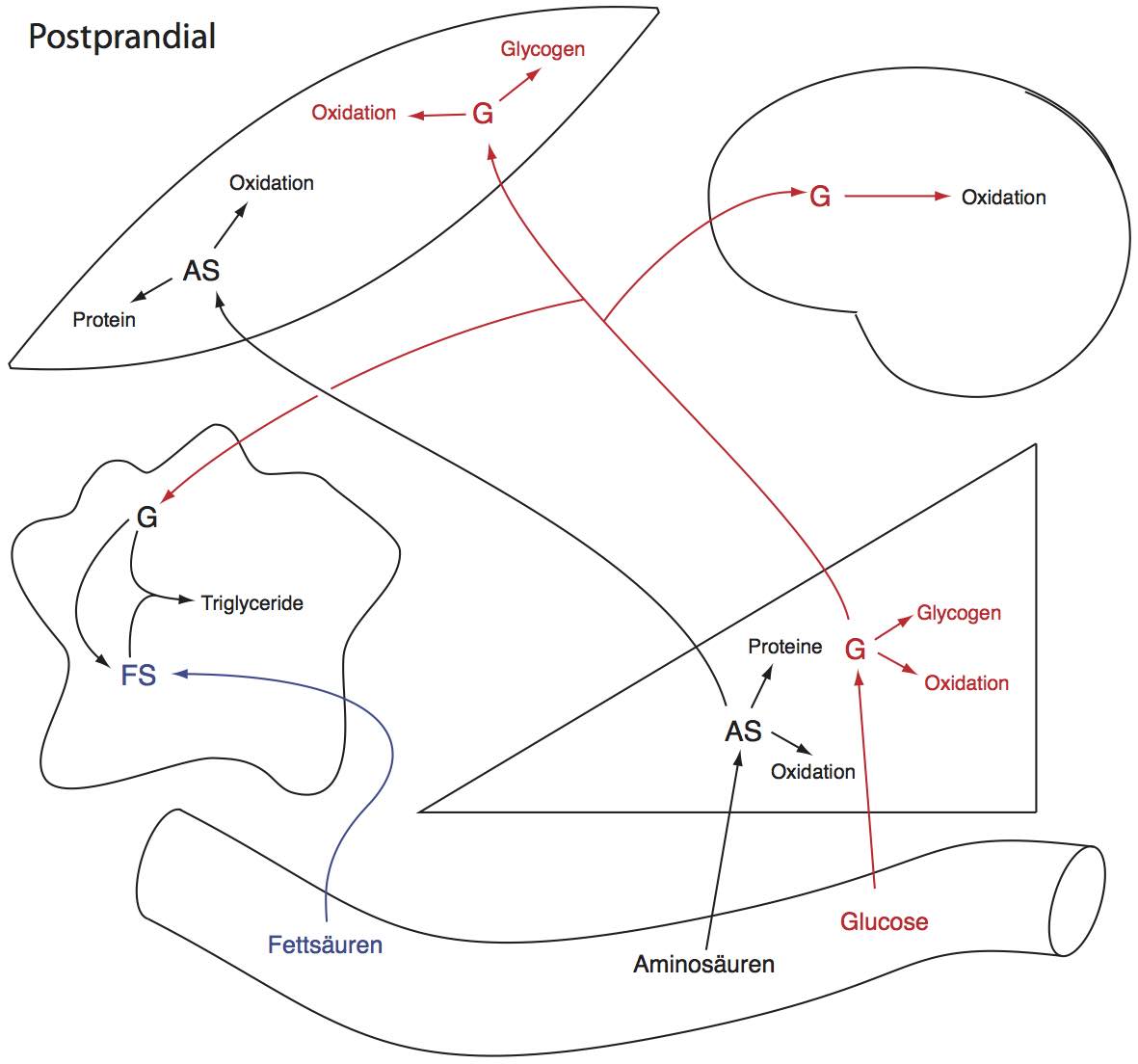
Fig. 1: Die postprandiale Phase. Darm, Fettgewebe (Mitte links), Leber, Muskel und Hirn (oben rechts) sind schematisch dargestellt. Die Fettsäuren werden zum grössten Teil als Triglyceride (in Lipoproteinen) transportiert, als Fettsäuren in die Zellen aufgenommen und dort als Triglyceride gespeichert (in der Abbildung verkürzt dargestellt!).
Die Nüchternphase
Der Stoffwechsel steht jetzt, da auch Insulin auf seinem Tiefpunkt angelangt ist, unter dem Einfluss von (v.a.) Adrenalin und Glucagon. Die Konsequenzen lassen sich aus der Figur 2 ablesen:
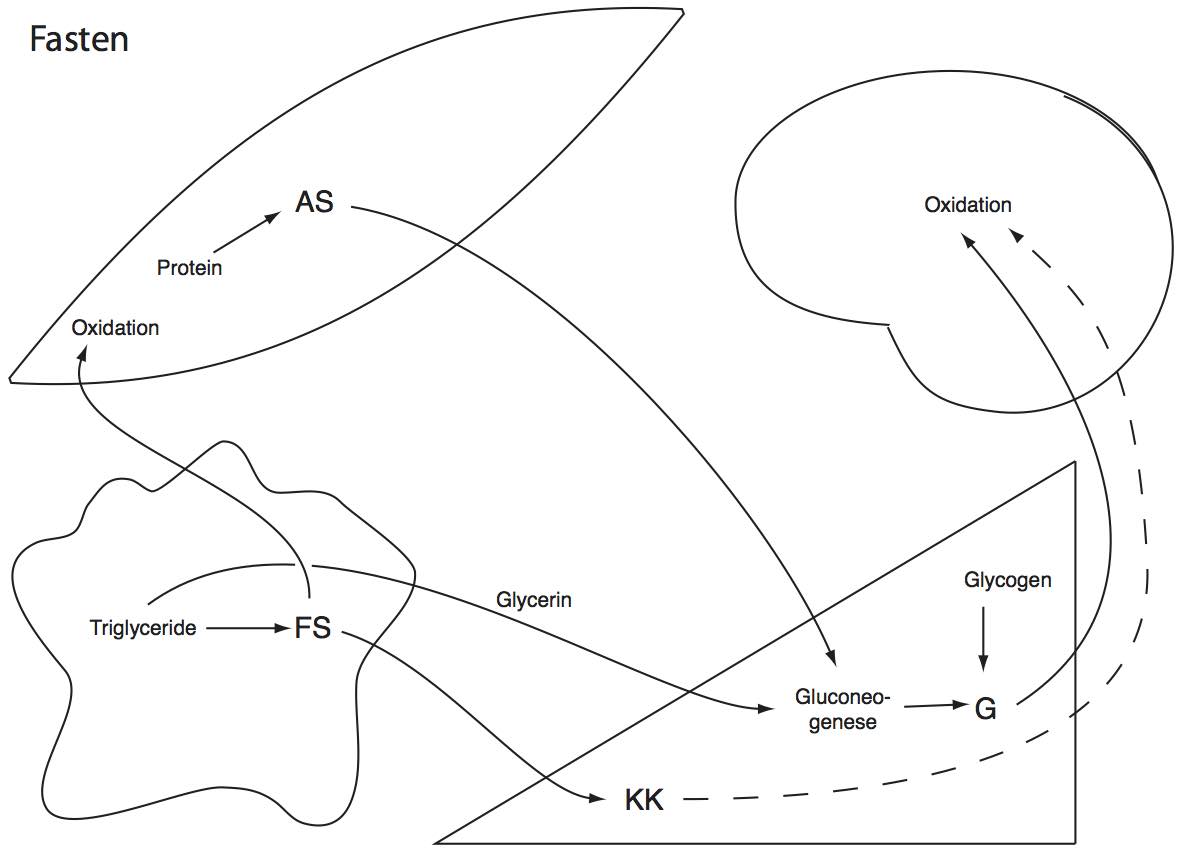
Fig. 2: Die Fastenphase.
Das in der Leber gespeicherte Glycogen ist morgens auf ca 50% des Maximalwerts gesunken. Würde man den ganzen Tag durch weiter fasten, blieben noch ca. 15% übrig. Die Gluconeogenese stellt ebenfalls Glucose zur Verfügung, als Substrate dienen neben Lactat aus dem anaeroben Metabolismus Aminosäuren aus Muskelproteinen und Glycerin aus der Lipolyse. Glucose ist immer noch der wichtigste Energielieferant des Hirns, aber Ketonkörper, deren Synthese in der Leber mit zumehmender Fastendauer steigt, übernimmt schon einen Teil.
Die Hungerphase
Die Hungerphase tritt ein, wenn das Fasten tage- oder sogar wochenlang dauert (Abb. 3). Sie ist, wie das Fasten, durch die Lipolyse und seine Folgen – hohe Konzentration freier Fettsäuren im Blut, verstärkter Fettsäureverbrauch in den Geweben und Ketonkörpersynthese in der Leber – charakterisiert. Aber die Gluconeogenese aus Aminosäuren wird eingeschränkt, denn auf die Länge wäre ein Muskelabbau mit dem Überleben nicht vereinbar. Das verkleinerte Glucoseangebot wird durch den stark angestiegenen Ketonkörperverbrauch des Gehirns kompensiert: Bis zu 70% des Energiebedarfs des Hirns können in der Hungerphase durch Ketonkörper gedeckt werden!
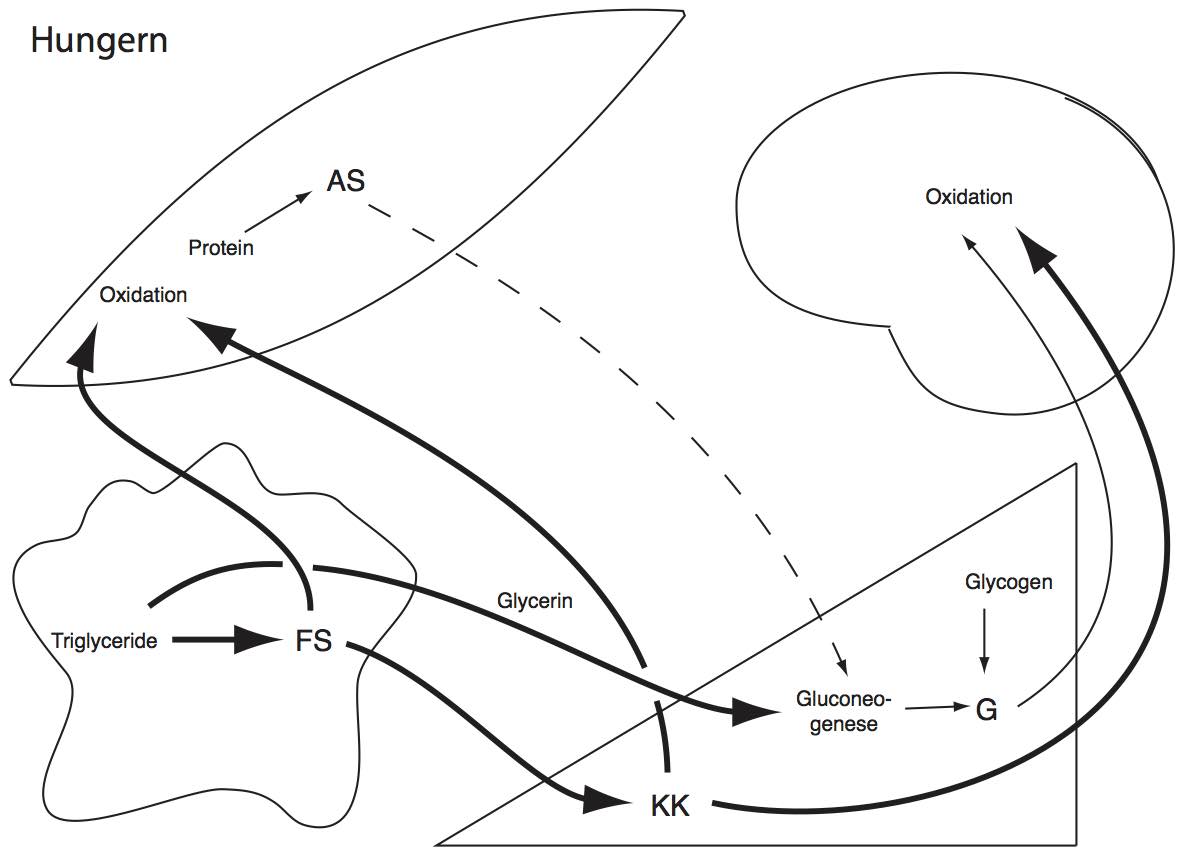
Fig. 3: Die Hungerphase.
Bemerkungen zur Glucose
Da einige Zellen und Organe (Erythrocyten, Nierenmark, Hirn) nicht ohne
Glucose auskommen, und weil aus (geradzahligen) Fettsäuren keine Glucose
synthetisiert werden kann, muss der Organismus im Hungerzustand Glucose
sparen. Wie Tabelle 1 an einem Beispiel zeigt, funktioniert das
problemlos: auch nach tagelangem Fasten sinkt die Glucosekonzentration im
Blut nicht unter einen zwar niedrigen, aber physiologisch problemlosen
Wert.
| Energieträger | 0h | 40h | 7 Tage |
|---|---|---|---|
| Glucose | 5.5 | 3.6 | 3.5 |
| Freie Fettsäuren | 0.3 | 1.15 | 1.19 |
| Ketonkörper | 0.05 | 2.5 | 4.5 |
So wie in einem Finanzhaushalt bei Bedarf Einnahmen (Steuern) erhöht und Ausgaben gekürzt werden können, stehen dem Organismus nicht nur die Gluconeogenese (Steuern), sondern auch eine Sparmassnahme, die physiologische Insulinresistenz, zur Verfügung. Das Phänomen wurde 1846 vom französischen Physiologen Claude Bernard entdeckt und als Hungerdiabetes bezeichnet: wenn Versuchspersonen nach mehrtägigem Hungern eine Mahlzeit zu sich nahmen, konnte man danach in ihrem Urin eine erhöhte Glucosekonzentration feststellen. Der Grund liegt in einer Insulinresistenz, die den Glucoseverbrauch (wie bei einem Diabetiker) vermindert. Natürlich handelt es sich dabei nicht um einen wirklichen Diabetes, denn die Resistenz ist reversibel und verschwindet innerhalb 48 Stunden.
Zu beachten ist auch, dass Erythrocyten und das Nierenmark zwar Glucose "brauchen", aber nicht "ver"brauchen. Denn das Endprodukt des anaeroben Stoffwechsels, Lactat, kann in der Leber zu Glucose resynthetisiert werden. Das "kostet" zwar etwas (ATP), aber die Leber gewinnt das ATP aus Fettsäuren, von denen es während langer Zeit genug hat. Es ist bemerkenswert, dass auch das Hirn im Hungerzustand Lactat exportiert, d.h. nicht sämtliche Glucose vollständig oxidiert. Das mag auf den ersten Blick erstaunen, weil dadurch bloss 2 ATP pro Glucose gewonnen werden, ist aber verständlich, weil Glucose so mehrmals den anaeroben Zyklus durchlaufen kann – auf Kosten der Fettreserven.
Wie schon erwähnt, sinkt der Glycogenspeicher der Leber innerhalb von 24 Stunden auf bloss noch etwa 15%. Aber für das Muskelglycogen trifft dies nicht zu: der Glycogengehalt des Muskels bleibt unverändert, ja, in einzelnen Studien stieg er in der Hungerphase, sogar leicht an. Für den Gesamtorganismus steht dieses Glycogen natürlich nicht zur Verfügung, da Glucose nicht aus Muskelzellen exportiert werden kann.
Bemerkungen zu den Fettsäuren
Aus der Tabelle 1 ist ersichtlich, dass die Konzentration freier Fettsäuren (FFS) mit zunehmendem Fasten/Hungern stark ansteigt. Es werden mehr Fettsäuren durch Lipolyse freigesetzt als für die Energieversorgung benötigt. (Warum? Vielleicht, weil es der Organismus auf das Glycerin, ein wichtiges Substrat für die Gluconeogenese, abgesehen hat). Als Folge ist im Hungerzustand neben der FFS-Konzentration im Blut auch die Triglycerid-Einlagerung im Skelett- und im Herzmuskel erhöht.
Die folgenden Abbildungen dienen dem Verständnis des Kommentars:
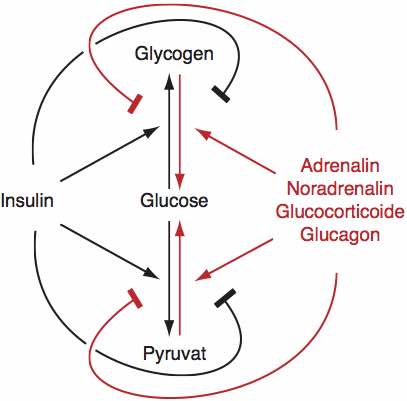
Abb. 3.4 (p. 37): Regulation der Blutglucosekonzentration.
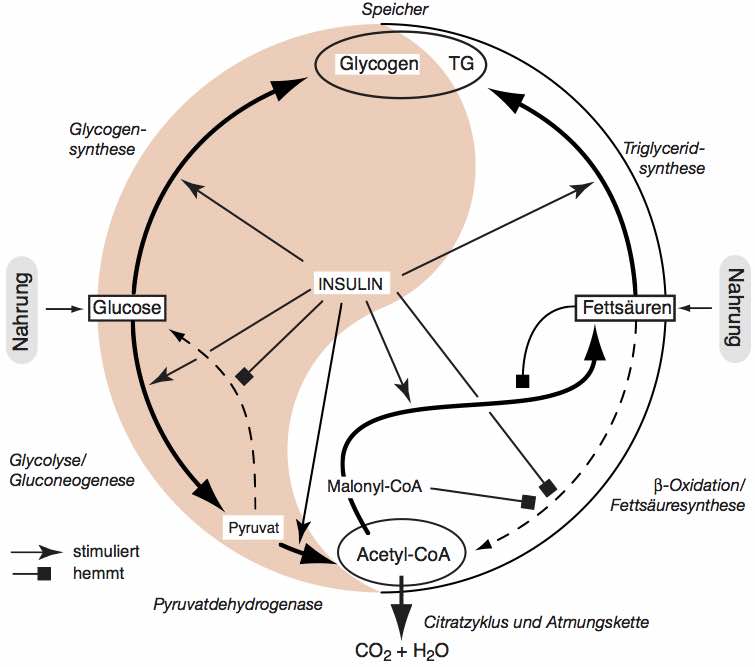
Abb. 10.7 (p. 141): Insulin und der Leberstoffwechsel.